
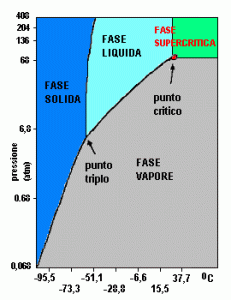
 Con il termine supercritico si definisce qualsiasi composto chimico, o miscela di composti, che ha raggiunto il suo punto critico (Pc). Solitamente si utilizzano sostanze pure, in quanto sono più semplici da gestire e monitorare. Per comprendere meglio questo aspetto, risulta essere di grande aiuto il diagramma di fase. Con questo strumento si può comprendere come, al variare della pressione (P) e della temperatura (T), lo stato della materia può mutare. Oltre agli stati solido, liquido e gassoso, più universalmente conosciuti, vi è anche lo stato supercritico, che si manifesta quando vengono raggiunti determinati valori di P e T, denominate Pressione Critica (Pc) e Temperatura Critica (Tc). Questo diagramma è composto e suddiviso da alcuni curve e aree che denotano alcune caratteristiche peculiari della sostanza in questione come:
Con il termine supercritico si definisce qualsiasi composto chimico, o miscela di composti, che ha raggiunto il suo punto critico (Pc). Solitamente si utilizzano sostanze pure, in quanto sono più semplici da gestire e monitorare. Per comprendere meglio questo aspetto, risulta essere di grande aiuto il diagramma di fase. Con questo strumento si può comprendere come, al variare della pressione (P) e della temperatura (T), lo stato della materia può mutare. Oltre agli stati solido, liquido e gassoso, più universalmente conosciuti, vi è anche lo stato supercritico, che si manifesta quando vengono raggiunti determinati valori di P e T, denominate Pressione Critica (Pc) e Temperatura Critica (Tc). Questo diagramma è composto e suddiviso da alcuni curve e aree che denotano alcune caratteristiche peculiari della sostanza in questione come:
- Regioni del diagramma: aree delimitate da alcune curve in cui si identificano i diversi stati di aggregazione della sostanza chimica presa in esame.
- Curve del diagramma: curve costituite da tutti quei valori puntiformi dati dalla corrispondenza di T sull’asse delle ascisse e di P su quello delle ordinate, in cui coesistono almeno 2 fasi diverse contemporaneamente, sono dette curve di transizione di stato e sono sostanzialmente 3:
- Sublimazione/Brinamento: indica la coesistenza della fase solida e gassosa. Scostandosi leggermente da questi valori avviene il completo passaggio della materia dallo stato solido a quello gassoso (Sublimazione) e viceversa (Brinamento).
- Fusione/Solidificazione: indica la coesistenza della fase solida e liquida. Scostandosi leggermente da questi valori avviene il completo passaggio della materia dallo stato solido a quello liquido (Fusione) e viceversa (Solidificazione).
- Vaporizzazione/Condensazione: indica la coesistenza della fase gassosa e liquida. Scostandosi leggermente da questi valori avviene il completo passaggio della materia dallo stato gassoso a quello liquido (Condensazione) e viceversa (Vaporizzazione).
- Punto Triplo: identifica il punto in cui coesistono le tre fasi solida, liquida e gassosa.
- Punto Critico: identifica il punto in cui termina la curva liquido/gas, a queste condizioni si raggiungono Tc e Pc per le quali le due fasi sono indistinguibili in quanto hanno pari densità.
- Fase supercritica: questa regione del diagramma non ha confini marcati da curve di fase come le altre, ma viene arbitrariamente indicata quando vengono superati i valori di Pc e Tc. In questa fase la sostanza ha proprietà tipiche miste sia dei liquidi che dei gas.
Per quanto riguarda la CO2 la fase supercritica può essere raggiunta con una spesa energetica relativamente bassa, in quanto il Pc è caratterizzato da Tc pari a 31 °C e Pc pari a 73,8 bar.



